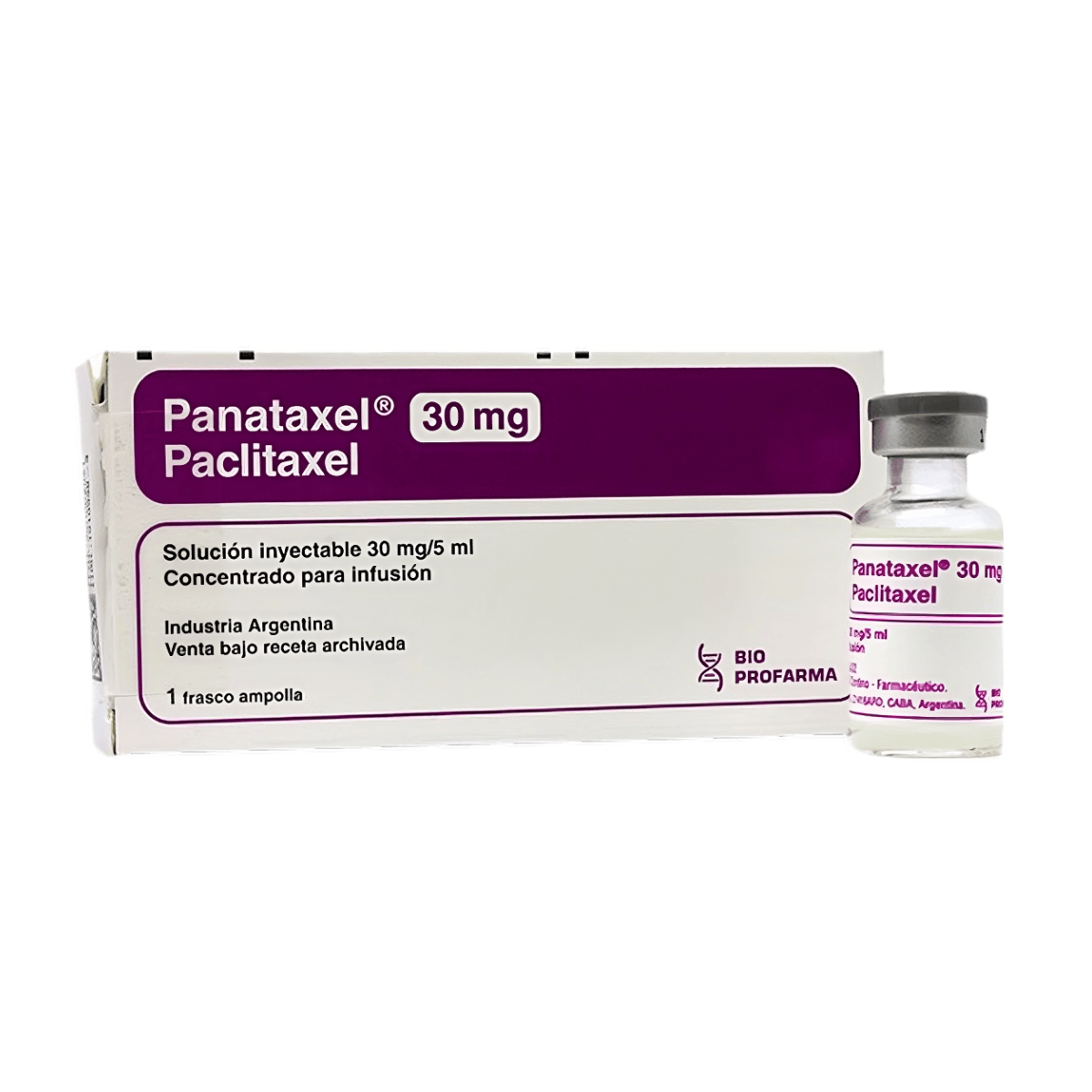
PRINCIPIO ACTIVO
Paclitaxel 30 mg.
Paclitaxel 300 mg.
TIPO
Solución inyectable concentrado para infusión.
PRESENTACIÓN
Envases con 1 frasco ampolla de solución inyectable concentrado para infusión conteniendo 5 ml (30 mg) y 50 ml (300 mg).
ACCIÓN TERAPÉUTICA
Antineoplásico.
Description
Description
FÓRMULA
Panataxel solución estéril para inyección contiene por ml:
Paclitaxel 6 mg.
Aceite de Castor Polioxilado 35 527 mg.
Alcohol absoluto c.s.p. 1 ml.
INDICACIONES
Panataxel está indicado en primera línea, en combinación con Cisplatino, para el tratamiento del cáncer de ovario avanzado.
Panataxel también está indicado en líneas de tratamiento posteriores.
Panataxel está indicado en combinación con Cisplatino, para el tratamiento en primera línea del cáncer de pulmón de células no pequeñas, en pacientes que no son candidatos a una potencial cirugía curativa y/o radioterapia.
Panataxel está indicado en segunda línea de tratamiento en el sarcoma de Kaposi relacionado al SIDA.
Panataxel está indicado en el tratamiento del carcinoma de mama metastásico tras el fracaso de la quimioterapia combinada o en recaídas producidas luego de 6 meses de quimioterapia adyuvante. El tratamiento previo debe haber incluido una antraciclina a menos que exista una contraindicación clínica para las mismas.
Panataxel está indicado en adyuvancia para el tratamiento del cáncer de mama con nódulo positivo, administrado en forma secuencial con esquemas de quimioterapia con doxorrubicina. La evidencia aportada por los ensayos clínicos, demostró un beneficio en la supervivencia global y libre de enfermedad en la población total de pacientes con tumores receptores-positivos y receptores-negativos, pero este beneficio fue demostrado en forma específica (seguimiento medio mayor de 30 meses) sólo en pacientes con tumores receptores-negativos de estrógenos y progesterona.
POSOLOGÍA Y FORMA DE ADMINISTRACIÓN
Nota: No se recomienda el contacto del concentrado sin diluir con dispositivos o componentes utilizados para la preparación de soluciones para infusión que contengan PVC plastificados.
Para minimizar la exposición del paciente con plásticos que contengan DEHP ([di-(2-tilhexil)ftalato]), el cual puede ser liberado desde las bolsas que contenga PVC, la solución diluida de Panataxel debe ser almacenada en botellas de vidrio o polipropileno, o bolsas de plástico de polipropileno o poliolefina y ser administrado a través de vías de administración de polietileno.
Todos los pacientes deben ser premedicados con el objeto de prevenir reacciones de hipersensibilidad severa. Dicha premedicación puede consistir en:
a) 20 mg de dexametasona por vía oral 12 y 6 horas antes de la administración de Panataxel.
b) 50 mg de difenhidramina o un equivalente, por vía intravenosa 30 a 60 minutos antes del Panataxel y
c) 300 mg de cimetidina o 50 mg de ranitidina, por vía intravenosa 30 a 60 minutos antes del tratamiento con Panataxel.
Cáncer de ovario
– Pacientes vírgenes de tratamiento para el cáncer de ovario. Se recomienda uno de los siguientes regímenes, cada 3 semanas. Deben considerarse las diferencias de toxicidad para seleccionar el régimen apropiado.
a) Panataxel 175 mg/m2 en forma intravenosa a ser administrado en tres horas, seguido por Cisplatino a 75 mg/m2 o
b) Panataxel 135 mg/m2 en infusión continua de 24 horas, seguido por Cisplatino a 75 mg/m2.
– Pacientes previamente tratadas. En esta clase de pacientes la dosis y esquemas de Panataxel pueden ser varios. La dosis recomendada de Panataxel® es de 135 o 175 mg/m2 administrado en forma intravenosa, en tres horas cada tres semanas.
Cáncer de pulmón de células no pequeñas
Se recomienda una dosis de Panataxel de 135 mg/m2 en infusión de 24 horas, seguido de Cisplatino 75 mg/m2. Este esquema se repetirá cada tres semanas.
Sarcoma de Kaposi relacionado a SIDA
Se recomienda una dosis de Panataxel de 135 mg/m2 a pasar en tres horas en forma intravenosa cada tres semanas o 100 mg/m2 con un mismo tiempo de infusión, pero cada dos semanas (intensidad de dosis: 45 – 50 mg/m2/semana). El primer esquema fue más tóxico. El último esquema (100 mg/m2 cada dos semanas) se recomienda en pacientes con baja performance. Teniendo en cuenta la inmunosupresión que tienen los pacientes con VIH avanzado, se recomiendan las siguientes modificaciones:
– Reducir la dosis de dexametasona a 10 mg vía oral (en vez de 20 mg);
– Iniciar o repetir el tratamiento con Panataxel sólo si el recuento de neutrófilos es al menos de 1.000 células/mm3;
– Reducir los cursos subsiguientes de Panataxel en un 20%, en aquellos pacientes que experimenten neutropenia severa (neutrófilos <500 células/mm3 por una semana o más);
– Iniciar en forma concomitante factores de crecimiento hemopoyético (G- CSF) si está clínicamente indicado.
Cáncer de mama
– Para el tratamiento adyuvante del cáncer de mama con: Tratamiento en adyuvancia de cáncer de mama con nódulo positivo: la dosis recomendada de Panataxel es de 175 mg/m2 en forma intravenosa administrada en tres horas cada tres semanas, por cuatro cursos. Estos deben aplicarse en forma secuencial luego del esquema de combinación que contiene doxorrubicina. En los ensayos clínicos el esquema que se utilizó fue doxorrubicina y ciclofosfamida en cuatro cursos.
– Después del fracaso de la quimioterapia inicial para la enfermedad metastásica o recaída dentro de los siguientes 6 meses de la quimioterapia adyuvante, la dosis recomendada de Panataxel es de 175 mg/m2, administrado por vía intravenosa durante 3 horas cada tres semanas.
Los cursos de administración de paclitaxel en pacientes con tumores sólidos (ovario, mama, cáncer de pulmón de células no pequeñas) no deberán reiterarse hasta que el recuento de neutrófilos alcance por lo menos 1.500 células/mm3, mientras que el valor correspondiente al recuento de plaquetas sea de al menos, 100.000 células/mm3. Panataxel no debe administrarse a pacientes con sarcoma de Kaposi relacionado a SIDA si el recuento de neutrófilos es menor a 1.000 células/mm3. Aquellos pacientes que experimentaron neutropenia severa (con neutrófilos con un valor de <500 células/mm3), durante una semana o más, o bien que experimentaron neuropatía periférica severa, durante la terapia con paclitaxel, deberán reducir la dosis en un 20 % en los siguientes cursos de administración de paclitaxel. La incidencia de la neurotoxicidad y la severidad de la neutropenia aumentan con la dosis.
Alteración de la Función Hepática
Los pacientes con alteración de la función hepática pueden tener un mayor riesgo de toxicidad, particularmente mielosupresión grado 3 – 4. Las recomendaciones para el ajuste de la dosis para el primer curso de tratamiento son mostradas en el siguiente cuadro, tanto para la infusión de 3 horas como para la de 24 horas. Reducciones adicionales de la dosis en cursos subsiguientes deberán estar basadas en la tolerancia individual. Los pacientes deben ser controlados muy de cerca por el desarrollo de una mielosupresión marcada.
Recomendaciones para la dosificación en pacientes con alteración de la función hepática.
Grado de alteración de la función hepática Infusión de 24 horas:
– Nivel de Transaminasas: <2 x VSN y Nivel de Bilirrubina: ≤1,5 mg/dl; Dosis de paclitaxel recomendada: 135 mg/m2.
– Nivel de Transaminasas: 2 – <10 x VSN y Nivel de Bilirrubina: ≤1,5 mg/dl; Dosis de paclitaxel recomendada: 100 mg/m2.
– Nivel de Transaminasas: <10 x VSN y Nivel de Bilirrubina: 1,6 – 7,5 mg/dl; Dosis de paclitaxel recomendada: 50 mg/m2.
– Nivel de Transaminasas: ≥10 x VSN o Nivel de Bilirrubina: >7,5 mg/dl;
Dosis de paclitaxel recomendada: No se recomienda Infusión de 3 horas.
– Nivel de Transaminasas: <10 x VSN y Nivel de Bilirrubina: ≤1,25 x VSN; Dosis de paclitaxel recomendada: 175 mg/m2.
– Nivel de Transaminasas: <10 x VSN y Nivel de Bilirrubina: 1,26 – 2,0 x VSN; Dosis de paclitaxel recomendada: 135 mg/m2.
– Nivel de Transaminasas: <10 x VSN y Nivel de Bilirrubina: 2,01 – 5,0 x VSN; Dosis de paclitaxel recomendada: 90 mg/m2.
– Nivel de Transaminasas: ≥10 x VSN o Nivel de Bilirrubina: >5,0 x VSN; Dosis de paclitaxel recomendada: No se recomienda.
Precauciones en la preparación y administración
Panataxel es una droga anticancerígena citotóxica y, en tal sentido, tal como sucede con otros compuestos potencialmente tóxicos, debe tenerse mucho cuidado cuando se manipula. Se recomienda el uso de guantes. Si la solución que Panataxel entra en contacto con la piel, lávela inmediatamente con abundante agua y jabón. Con posterioridad a la exposición tópica, se observaron efectos adversos tales como acantestesia, ardor y enrojecimiento. Si Panataxel entra en contacto con la membrana mucosa, deberá lavarse la membrana con abundante cantidad de agua. Luego de la inhalación del producto, se reportaron casos de disnea, dolor de pecho, ardor en los ojos, dolor de garganta y náuseas. Dada la posibilidad de extravasación, se aconseja monitorear el sitio donde se aplica la infusión ante la posibilidad de una infiltración durante la administración de la droga.
Preparación para la administración
Panataxel debe diluirse antes de su infusión. Panataxel puede ser diluido en solución de cloruro de sodio 0,9%, dextrosa al 5% y cloruro de sodio al 0,9% o dextrosa en Ringer para llegar a una concentración final de 0,3 a 1,2 mg/ml. Los productos parenterales deben inspeccionarse visualmente para verificar la ausencia de partículas extrañas o decoloración antes de la administración siempre que el envase y la solución así lo permitan. Al prepararlas, las soluciones pueden mostrar cierto enturbiamiento atribuible al vehículo de la formulación. Los datos recolectados para la presencia del plástico DEHP (es decir, el di-(2-etil- hexil)-Ftalato), indican que los niveles aumentan con el paso del tiempo y con la concentración cuando las soluciones son preparadas en envases de PVC. En consecuencia el uso de envases de PVC y de sets de administración de PVC no resulta recomendable. En tal sentido, las soluciones diluidas de paclitaxel deberán ser preparadas y almacenadas en frascos de vidrio, o en recipientes de polipropileno o poliolefina. Por lo tanto, no deberá utilizarse ningún set de administración que contenga PVC en su material de elaboración. Panataxel deberá ser administrado a través de un filtro con una membrana microporosa no mayor a los 0,22 micrones. La utilización de elementos para filtros, que poseen ya incorporados tubos de entrada y salida, recubiertos de PVC, no ha resultado en una liberación significativa del DEHP.
Manejo y disposición
Se deben considerar el manejo y la disposición adecuados de las drogas anticancerosas. Se han publicado guías al respecto. No hay acuerdo general de que todos los procedimientos recomendados en estas guías son necesarios o apropiados. Para minimizar el riesgo de exposición dérmica, usar siempre guantes cuando se manipulen envases que contengan paclitaxel. Esto debe realizarse para todas las actividades de manipuleo.
ADVERTENCIAS Y PRECAUCIONES
Panataxel solución inyectable deberá ser administrado bajo la supervisión de un profesional médico con experiencia en el uso de agentes quimioterapéuticos contra el cáncer. El manejo adecuado de aquellas complicaciones que pudieren surgir resulta posible sólo cuando se dispone de un diagnóstico e instalaciones apropiadas de manera inmediata. En el 2 – 4 % de los pacientes que recibieron paclitaxel durante los estudios de investigación clínica, se registraron anafilaxia y reacciones severas de hipersensibilidad caracterizadas por disnea e hipotensión que exigen tratamiento, angioedema y urticaria generalizada.
Se observaron reacciones fatales, a pesar de la premedicación. Todos los pacientes deberían ser tratados en forma previa con corticosteroides, difenhidramina y antagonistas H2. Aquellos pacientes que experimentaron reacciones severas de hipersensibilidad a los efectos de paclitaxel no deberán volver a recibir esta droga. No debería emplearse la terapia con paclitaxel en el caso de aquellos pacientes que padecen tumores sólidos y con recuentos de neutrófilos basales inferiores a 1.500 células/mm3, así como en pacientes con Sarcoma de Kaposi relacionado al SIDA con recuento de neutrófilos basales inferiores a 1.000 células/mm3. Para monitorear la ocurrencia de una supresión de la médula ósea, fundamentalmente neutropenia, que puede ser severa y llevar a una infección, se recomienda efectuar recuentos habituales de células en sangre periférica en todos los pacientes que reciben este medicamento.
Reacciones de Hipersensibilidad
No deberá tratarse con paclitaxel inyectable a aquellos pacientes con antecedentes de reacciones de hipersensibilidad severa a los productos que contienen aceite de castor polioxilado. Para evitar la ocurrencia de reacciones de hipersensibilidad aún más severas, todos los pacientes tratados con paclitaxel deberán ser premedicados con corticosteroides (por ejemplo, dexametasona), difenhidramina y antagonistas H2 (tales como cimetidina o ranitidina). El surgimiento de síntomas menores como por ejemplo, ruborización, reacciones en la piel, disnea, hipotensión o taquicardia no requiere la interrupción del tratamiento. Sin embargo, aquellas reacciones más severas, tales como hipotensión que requiere su correspondiente tratamiento, o como la disnea que exige el uso de broncodilatadores, angioedema o urticaria generalizada implican una inmediata discontinuación de paclitaxel así como una terapia sintomática agresiva. Aquellos pacientes que han desarrollado reacciones severas de hipersensibilidad no deberán someterse a un nuevo tratamiento con paclitaxel.
Hematológicas
No deberá recurrirse a una terapia con Panataxel en aquellos pacientes con recuentos basales de neutrófilos inferiores a 1.500 células/mm3. Durante el tratamiento con paclitaxel a fin de poder comprobar la existencia de mielotoxicidad, se recomienda la realización de un monitoreo frecuente del recuento periférico de la cantidad de células sanguíneas. Los pacientes no deben volver a ser tratados con ciclos posteriores de paclitaxel hasta comprobar que el recuento de neutrófilos recupera el nivel de más de 1.500 células/mm3 mientras se observa que el nivel de plaquetas se recupera hasta alcanzar las 100.000 células/mm3. En el caso de neutropenia severa (con un valor menor de 500 células/mm3 durante 7 días o más), durante un curso de terapia con paclitaxel, se recomienda una reducción del 20% de la dosis para los posteriores cursos de terapia. Para pacientes con enfermedad avanzada asociada a VIH y bajo riesgo de Sarcoma de Kaposi asociado a SIDA, paclitaxel puede ser iniciado y repetido (a la dosis recomendada para esta enfermedad) si el recuento de neutrófilos es de al menos 1.000 células/mm3.
Cardiovasculares
Con frecuencia se ha observado hipotensión, bradicardia e hipertensión durante la administración de paclitaxel. No obstante, en estos casos no resulta necesario recurrir a un tratamiento. En ocasiones, la administración de paclitaxel a través de infusiones debe interrumpirse o discontinuarse debido a hipertensión inicial o recurrente. Se recomienda un frecuente monitoreo de los signos vitales del paciente, en especial durante el transcurso de la primera hora de la infusión de paclitaxel siguiéndose un procedimiento por demás cuidadoso. No se requiere un monitoreo cardíaco continuo, salvo en los pacientes con serias anormalidades de la conducción. Cuando paclitaxel es utilizado en combinación con doxorrubicina para el tratamiento de cáncer de mama metastásico, se recomienda el monitoreo continuo de la función cardíaca. Se han documentado en <1% de los pacientes anormalidades en la conducción durante la terapia con paclitaxel, que en algunos casos requiere de un marcapasos. Si los pacientes desarrollan anormalidades de la conducción significativas durante la infusión con paclitaxel, se deberá administrar la terapia apropiada e instaurar un monitoreo cardíaco continuo durante la terapia subsecuente con paclitaxel.
Sistema Nervioso
Si bien resulta frecuente la ocurrencia de neuropatía periférica, el desarrollo de una sintomatología más severa no es habitual y exige una reducción de la dosis de un 20%, en lo que respecta a los posteriores cursos de tratamiento con paclitaxel. Panataxel contiene alcohol en su formulación. Esto se debe tener en cuenta sobre posibles efectos sobre el sistema nervioso central u otros efectos del alcohol.
Hepáticas
Existe evidencia limitada de que la mielotoxicidad por paclitaxel puede ser exacerbada en pacientes con bilirrubina sérica total >2 veces del VSN. Se debe tener cuidado extremo al administrar paclitaxel en estos pacientes.
Reacciones en el sitio donde se aplica la inyección
Las reacciones en el sitio de inyección, incluyendo las secundarias a la extravasación, son por lo general leves. Se mencionan eritema, hiperestesia, decoloración de la piel e hinchazón en el sitio donde se aplicó la inyección. Estas reacciones se han observado con mayor frecuencia dentro de la infusión de 24 horas que en el caso de la infusión de 3 horas de duración. En muy pocas oportunidades se reportaron casos de recurrencia de reacciones cutáneas en el sitio donde se aplicó la inyección tras haberse administrado paclitaxel en un sitio diferente. Se registraron episodios más severos tales como flebitis, celulitis, induración, exfoliación cutánea, necrosis y fibrosis. En algunos casos, el inicio de la reacción en el sitio donde se aplicó la inyección se produjo durante una infusión prolongada o bien se retrasó por 7 a 10 días. Se desconoce la existencia de un tratamiento específico contra la extravasación. Dada la posibilidad de extravasación, se aconseja monitorear el sitio donde se aplica la infusión ante la posibilidad de una infiltración durante la administración de la droga.
Incompatibilidad con materiales de PVC
No se recomienda el contacto del concentrado no diluido con equipos o dispositivos de PVC usados para preparar soluciones para infusión. Con el objeto de minimizar la exposición al paciente del plastificante DHEP (di – (2- etilhexil) ftalato) que puede ser liberado de las bolsas o sets de infusión de PVC, las soluciones diluidas de paclitaxel deben ser almacenadas preferentemente en botellas (vidrio, polipropileno) o bolsas plásticas (polipropileno, poliolefina) y administrado a través de sets de administración con vías de polietileno. Panataxel debe administrarse a través de un filtro en línea con una membrana microporosa no mayor a 0,22 micrones.
Interacciones medicamentosas
Cuando se administran dosis escaladas de Paclitaxel (110 – 200 mg/m2) y de Cisplatino (50 ó 75 mg/m2), en infusiones secuenciales, se constata que la mielosupresión es más profunda cuando se administra luego de haberse suministrado Cisplatino, que en el orden inverso (es decir aclitaxel antes que Cisplatino). Los datos farmacocinéticos en estos pacientes evidenciaron un descenso en el aclaramiento de paclitaxel de alrededor del 33% cuando paclitaxel fue administrado luego de la dosis de Cisplatino. El metabolismo de paclitaxel es catalizado por el citocromo P450 (isoenzimas CYP2C8 y CYP3A4).
Se debe tener precaución cuando paclitaxel se administra en forma concomitante con sustratos conocidos (como ser midazolam, buspirona, felodipino, lovastatina, eletriptán, sildenafil, simvastatina y triazolam), inhibidores (como atazanavir, claritromicina, indinavir, itraconazol, ketoconazol, nefazodona, nelfinavir, ritonavir, saquinavir y telitromicina), e inductores (por ejemplo rifampicina y carbamazepina) de CYP3A4. A su vez, se debe tener precaución cuando paclitaxel se administra junto con sustratos conocidos (como repaglinida y rosiglitazona) inhibidores (como el gemfibrozilo), e inductores (como la rifampicina) de CYP2C8. No han sido evaluadas en pruebas clínicas las interacciones potenciales entre paclitaxel, un sustrato de CYP3A4, y los inhibidores de proteasa (ritonavir, saquinavir, indinavir y nelfinavir), que son sustratos y/o inhibidores de CYP3A4. Según informes científicos, los niveles plasmáticos correspondientes a doxorrubicina (y su metabolito activo, doxorrubicinol) pueden verse incrementados cuando paclitaxel y doxorrubicina son administrados en forma combinada.
Carcinogénesis. Mutagénesis. Dificultades en materia de Fertilidad
No se ha estudiado el potencial carcinogénico del paclitaxel. Se ha demostrado que paclitaxel ha resultado ser mutagénico en los sistemas de tests mamarios in vitro (se observaron aberraciones cromosómicas en linfocitos humanos) e in vivo (en los tests del micronúcleo en ratones); sin embargo este producto no induce mutagenicidad en el test de Ames y en el ensayo de la mutación del gen CHO/HGPRT. La administración de paclitaxel previo a y durante el apareamiento produjo trastornos de la fertilidad en ratas machos y hembras a dosis iguales o mayores que 1 mg/kg/día (aproximadamente 0,04 la dosis humanas recomendada máxima diaria expresada en mg/m2). A esta dosis, paclitaxel disminuyó la fertilidad e índices reproductivos y aumentó la embrio y fetotoxicidad. Paclitaxel puede causar daño fetal cuando se administra a una mujer embarazada. La administración de paclitaxel durante el período de organogénesis en conejos a dosis de 3 mg/kg/día (cerca de 0,2 veces la dosis diaria recomendada en humanos en base a mg/m2) causó toxicidad embrional y fetal, indicada por mortalidad intrauterina, e incremento en las resorciones y en la muertes fetales. También se observó toxicidad materna a esta dosis. No se observaron efectos teratogénicos a dosis de 1 mg/kg/día (alrededor de 1/15 de la dosis diaria recomendada en humanos en base a mg/m2); no se ha podido evaluar el potencial teratogénico a dosis más elevadas debido a la extensa mortalidad fetal.
Embarazo
Categoria D
No hay estudios bien controlados y adecuados en mujeres embarazadas. Si paclitaxel se usa durante el embarazo o si la paciente queda embarazada mientras recibe la droga, debe ser advertida del daño potencial al feto. Las mujeres en edad fértil deben ser aconsejadas para evitar quedar embarazadas.
Lactancia
Se desconoce si paclitaxel se excreta en leche humana. Debido a que muchas drogas son excretadas en la leche humana y a que existe potencial de reacciones adversas serias en los lactantes con paclitaxel, se recomienda suspender la lactancia si la madre es tratada con Panataxel.
Empleo en pediatría
No han sido establecidas la seguridad y efectividad de paclitaxel en pacientes pediátricos.
Empleo en geriatría
La mielosupresión y la neuropatía severa son más frecuentes en los pacientes ancianos. Las estimaciones de la eficacia parecen similares en pacientes ancianos y en los jóvenes. Sin embargo, no hay suficiente información para determinar con confianza la eficacia comparativa. También se observó que los pacientes ancianos tienen una supervivencia menor a los pacientes más jóvenes.
Insuficiencia renal
No existen recomendaciones de ajuste de dosis para pacientes con insuficiencia renal.
Insuficiencia hepática
Se deberá ajustar la dosis en pacientes con insuficiencia hepática de acuerdo a sus niveles de transaminasas y bilirrubina sérica.
CONTRAINDICACIONES
Panataxel está contraindicado para los pacientes con antecedentes de reacciones de hipersensibilidad a paclitaxel o a otras drogas formuladas en Cremophor (aceite de castor polioxilado).
No deberá utilizarse en pacientes con neutropenia <1.500 células/mm3 o en pacientes con Sarcoma de Kaposi asociado a SIDA con un recuento basal de neutrófilos <1.000 células/mm3.